laurent91Equipe du forum
laurent91Equipe du forum

 Age : 51
Age : 51
Nombre de messages : 121
Inscription : 15/04/2009
Localisation : quincy sous sénart
Emploi : employé
Passions : informatique, cinéma, sciences, ufologie
Règlement : Règlement
Points de Participation : 5880
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Jeu 18 Juin 2009, 17:09
"la fin du cirque" c'est un peu vite dit je trouve, je les ai toutes lues, elles contiennent quand même des concepts scientifiques très complexes et très audacieux surtout...il est très facile de détruire des théories en disant que telle ou telle chose est un plagiat ou une récupération...en tous cas si elle ont été écrites par un seul homme, il aurait dû écrire des livres de SF ou de fantasy, il aurait fait fortune...
je pense qu'il faut rester ouvert vis à vis de ce sujet
je pense qu'il faut rester ouvert vis à vis de ce sujet
 Léon.DEquipe du forum
Léon.DEquipe du forum

 Age : 75
Age : 75
Nombre de messages : 2104
Inscription : 21/10/2007
Localisation : charleroi
Emploi : pensionné
Passions : peche ,bricolage,poules naines .témoin vague belge
Règlement : Règlement
Points de Participation : 7383
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Jeu 18 Juin 2009, 17:49
Monsieur froisson en a discutté hier sur odhtv ,ce monsieur qui n'est pas des moindres dit qu'il ne croit pas a cela et que c'est illisible et vous vous arrivez a les lire .Je pense qu'il serait bon d'arreter avec ces suppositions qui ne sont fondées sur rien de concret .Cordialement .
 JérômeEquipe du forum
JérômeEquipe du forum

 Age : 52
Age : 52
Nombre de messages : 809
Inscription : 02/01/2009
Localisation : Ile de La Réunion
Emploi : ********
Passions : Famille, nature, zinzinlogie, moto, gastronomie
Règlement : Règlement
Points de Participation : 6620
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Jeu 18 Juin 2009, 18:11
MODERATION:
A titre d'exemple voici pourquoi l'Administrateur et la modérations sont toujours très réticents à aborder des sujets "délicats" liés aux OVNIs, que ce soit de près ou de loin!
Ce sujet est verrouillé malgré des commentaires intéressants.
Je rappelle que nous sommes sur un Forum sérieux.
Veillez donc à bien vous conformer au règlement: relisez le règlement si vous souhaitez vous exprimer sur un sujet délicat, ou adressez vous d'abord à la modération.
Pensez a lire l'intégralité des messages (je sais 2 pages peuvent en rebuter) mais ce n'est qu'à ce prix que nous pourrons aborder les sujets délicats.
Cordialement
A titre d'exemple voici pourquoi l'Administrateur et la modérations sont toujours très réticents à aborder des sujets "délicats" liés aux OVNIs, que ce soit de près ou de loin!
Ce sujet est verrouillé malgré des commentaires intéressants.
Je rappelle que nous sommes sur un Forum sérieux.
Veillez donc à bien vous conformer au règlement: relisez le règlement si vous souhaitez vous exprimer sur un sujet délicat, ou adressez vous d'abord à la modération.
Pensez a lire l'intégralité des messages (je sais 2 pages peuvent en rebuter) mais ce n'est qu'à ce prix que nous pourrons aborder les sujets délicats.
Cordialement
_______________________________________
"Il est temps de découvrir que tous les systèmes de pensée sont en réalité des systèmes pour EVITER de penser !" Aimé Michel
« Seuls, les charlatans drapés dans leur imbécillité peuvent croire aux ballons-sondes, aux phantasmes et aux hallucinations toutes les fois que l’univers s’exprime dans un langage non conforme à cet amas de concepts traditionnels et d’idées préconçues qu’ils considèrent comme la seule vérité. » Jean Cocteau
 Benjamin.dResponsable du forum
Benjamin.dResponsable du forum

 Age : 46
Age : 46
Nombre de messages : 12825
Inscription : 11/03/2007
Localisation : France
Emploi : Privé
Passions : Ufologie, Histoire, lecture
Règlement : Règlement
Points de Participation : 21511
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Jeu 18 Jan 2018, 19:07
Attention quand même. JP en a déduit la mhd, et les univers gemellaires mais de la science fiction peut inspirer la science d'aujourd'hui. Les inventeurs des lettres se sont bases sur des spéculations scientifiques de l'époque et donc ces spéculations peuvent devenir réalité
_______________________________________
Veuillez svp respecter le forum en postant des messages sérieux et constructifs sans SMS. Merci à l'avance et bonne lecture.
Rendez-vous sur le blog Ovni et vie extraterrestre :http://ovni-extraterrestre.com/ Poster votre témoignage: Cliquer ici Perte de mot de passe: cliquer ici
 InvitéInvité
InvitéInvité
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Ven 21 Sep 2018, 18:15
Allez pour votre week-end... + de trois heures trente d'émission avec GardenTeaPot & Christel Seval sur RIM.
@+
@+
 snotgobblerEquipe du forum
snotgobblerEquipe du forum

 Age : 65
Age : 65
Nombre de messages : 232
Inscription : 04/07/2019
Localisation : Grand est
Emploi : sans
Passions : la vie
Règlement : Règlement
Points de Participation : 2381
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Lun 21 Oct 2019, 22:03
La science confirme la perception dermique des couleurs par un insecte.
Un article de NATURE vient dévoiler cette capacité étonnante d'une chenille qui lui permet d'adapter sa couleur à son environnement.
Quel rapport avec les Ummites ? Dans la lettre D99, ils affirment percevoir les couleurs avec leurs doigts ainsi que leur poignet.
Traduction Deepl pour les non anglicistes. Attention: très long article scientifique.
Le changement adaptatif de couleur et le comportement de choix de l'arrière-plan chez la chenille de la tordeuse poivrée sont remédiés par la photoréception extra-oculaire.
Amy Eacock, Hannah M. Rowland, Arjen E. van't Hof, Carl J. Yung, Nicola Edmonds & Ilik J. Saccheri
Communications Biology volume 2, Article : 286 (2019) | Télécharger Citation
Paramètres de l'article
Résumé
La détection de la lumière par les tissus distincts de l'œil se produit dans divers groupes d'animaux, ce qui permet un contrôle circadien et un comportement phototactique. Les photorécepteurs extraoculaires peuvent également faciliter un changement de couleur rapide chez les céphalopodes et les lézards, mais on en sait peu sur le système sensoriel qui intervient dans le changement de couleur lent des arthropodes. Nous avons déjà signalé que le lent changement de couleur des chenilles imitant les chenilles des brindilles de la pyrale poivrée (Biston betularia) est une réponse aux repères visuels achromatiques et chromatiques. Nous montrons ici que la perception de ces signaux, et les réponses phénotypiques qui en résultent, ne nécessitent pas de vision oculaire. Les chenilles à ocelles complètement obscurcis sont restées capables d'améliorer leur crypsis en changeant de couleur et en choisissant de se reposer sur des rameaux de couleur assortie. Une suite de gènes visuels, exprimés à travers le tégument larvaire, joue probablement un rôle clé dans le mécanisme. À notre connaissance, il s'agit de la première preuve que la détection extraoculaire de la couleur peut médier le changement de couleur et le comportement des pigments chez un arthropode.
Introduction
La photoréception cutanée, c'est-à-dire la capacité de percevoir l'information photique à travers la peau indépendamment des yeux, a évolué un certain nombre de fois pour servir une variété de fonctions1,2,3,4. Elle est surtout connue pour son implication dans les réflexes d'ombre, la phototaxie et l'orientation en réponse à la lumière5. Plus récemment, on a proposé que la photoréception cutanée (plus généralement appelée photoréception extraoculaire) serve de médiateur pour le changement rapide (physiologique) de couleur observé chez les céphalopodes6,7, les poissons8 et les reptiles9, par le réarrangement des granules de pigment ou des plaquettes réfléchissantes dans des cellules spécialisées appelées chromatophores. Un changement de couleur lent (morphologique), se produisant sur des heures ou des semaines, est fréquent chez les arthropodes10,11. Plusieurs études ont démontré que les caractéristiques du substrat12 et la longueur d'onde de la lumière13 influencent la couleur de la nymphe chez une variété d'espèces de papillons14, en supposant qu'ils utilisent leurs yeux pour percevoir les stimuli de couleur. Des expériences pionnières menées par l'entomologiste victorien Edward Bagnall Poulton sur le contrôle de la couleur des nymphes du petit papillon écaille, Aglais urticae, ont été les premières à mettre en évidence une photoréception extraoculaire chez les arthropodes à changement de couleur15. Ce n'est que récemment que les chercheurs ont réexaminé la possibilité que la photoréception extraoculaire soit impliquée dans le lent changement de couleur des arthopodes16. Étant donné la prévalence d'un changement de couleur lent, des recherches sont nécessaires pour examiner l'importance de la photoréception extraoculaire dans cette catégorie de changement de couleur et pour caractériser la base physiologique de ce phénomène biologique sous-exploré.
Le papillon poivré (Biston betularia) a évolué pour devenir un prédateur très cryptique pour les prédateurs visuels, tant au stade adulte que larvaire. La crypsis est obtenue par des mécanismes contrastés à chaque étape. Le polymorphisme (mélanisme) du motif coloré adulte est déterminé génétiquement17,18, tandis que les larves se camouflent grâce à une combinaison de mascarade imitant les brindilles19 et de plasticité de la couleur20. Le changement de couleur de ces larves polyphages est une norme de réaction continue en réponse à des indices de couleur provenant des rameaux dans l'environnement immédiat des larves plutôt que des feuilles qu'elles mangent20. La précision de cette réponse de couleur et de motif est en désaccord avec la simple larve ocelli21 et la position distale de la tête par rapport au rameau lorsque les larves sont en position de repos. Nous avons supposé que les larves pourraient utiliser un sens visuel supplémentaire. Nous présentons ici les résultats d'expériences morphologiques, comportementales et d'expression génique visant à étudier le rôle de la photoréception extraoculaire chez les larves de B. betularia qui changent de couleur.
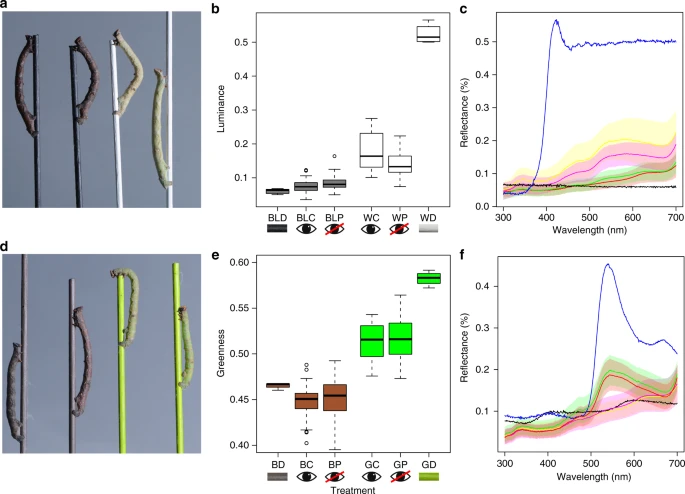
Nous avons élevé 321 larves de 4 familles en groupes répliqués de 25 individus, à l'intérieur de boîtes en plastique transparent contenant des rameaux artificiels entrecroisés (chevilles peintes), sur des feuilles fraîches sans pédoncule du saule gris, Salix cinerea (voir'Méthodes'). Nous avons peint les ocelles des chenilles avec de la peinture acrylique noire à l'aide d'un microscope (Fig. 1). Cette obstruction de la vision oculaire ou'bandage des yeux' a commencé à la fin du deuxième au début du troisième stade, qui est le stade le plus précoce auquel les larves peuvent être effectivement bandés les yeux, et précède une forte réponse colorée. Pour surmonter le problème des chenilles qui perdent leur bandeau dans le processus de mue entre les stades, nous avons vérifié les chenilles deux fois par jour pour déceler les premiers signes de glissement des capsules de la tête. Le glissement de la capsule de la tête prend environ 12 à 18 heures, pendant lesquelles nous avons tenu ces personnes séparément et individuellement toute la nuit dans des boîtes blanches opaques sans aucun goujon. De la peinture fraîche a été appliquée sur la nouvelle capsule de tête, empêchant ainsi les chenilles de recevoir un signal de couleur de goujon, et les chenilles ont été retournées dans leur compartiment de groupe. Nous avons utilisé quatre couleurs de chevilles différentes, avec une couleur par boîtier : brun, vert, noir et blanc (voir'Méthodes'). La première paire de couleurs différait en chroma et luminance ; la seconde paire différait seulement en luminance. La réflectance spectrale du tégument de chaque chenille a été mesurée au stade final (sixième) à l'aide d'un spectrophotomètre (six mesures sans chevauchement). Nous avons utilisé un modèle informatique de la perception visuelle pour quantifier la couleur et la luminance des larves telles qu'elles seraient perçues par un prédateur aviaire, la mésange bleue, Cyanistes caeruleus22. Nous avons calculé comment les chenilles vertes apparaissaient à un prédateur comme le rapport des réponses des cônes de longueur d'onde moyenne et longue, la luminance de chaque chenille comme les réponses des cônes double dorsal (DD) et la discriminabilité des larves comme des unités de " différences simplement perceptibles (JND) " (voir " Méthodes ").
Fig. 1
figure1
B. chenille de contrôle de B. betularia montrant un anneau de cinq ocelles encerclés en jaune et un sixième ocelle ventral encerclé séparément. b Exemple d'une larve de stade final avec ocelles masqués par de la peinture acrylique noire opaque. La barre d'échelle représente 1 mm
Image pleine grandeur
Résultats
Changement de couleur
Nous avons constaté un changement frappant de la couleur de l'ensemble du corps en l'absence d'information visuelle des yeux, ce qui fait que les chenilles ont non seulement changé de couleur pour ressembler à la couleur des goujons dans leur enclos, mais elles l'ont fait au même degré que les témoins non aveuglés. Ceci est évident pour l'œil humain (Fig. 2a, d), ainsi que par la comparaison des courbes de réflectance spectrale dans la gamme des longueurs d'onde visibles (Fig. 2c, e). Cependant, l'évaluation la plus critique et la plus pertinente sur le plan écologique se fait à travers le prisme de la perception d'un prédateur aviaire, que nous avons quantifiée par modélisation psychophysique. Vu à travers cette lentille, les larves de B. betularia élevées dans des enclos de goujons blancs étaient significativement plus brillantes que celles élevées sur des chevrons noirs, lorsqu'elles étaient mesurées comme les réponses à double cône de la rétine aviaire (F1,127 = 177,4, P < 0,0001 ; figure 2b), mais aucun effet significatif du bandé des yeux sur la luminance de la larve des traitements noir ou blanc (F1,127 = 0,28, P = 0,6). Les larves élevées dans des enclos de chevilles vertes étaient significativement plus vertes pour un prédateur aviaire que les larves issues de traitements bruns (F1,169 = 451.2, P < 0.0001 ; Fig. 2e). De plus, le fait de bander les yeux n'a pas eu d'effet significatif sur le verdissement des larves dans les traitements vert ou brun (F1,169 = 0,67, P = 0,4), et la distribution du verdissement était semblable entre les larves aveuglées et les larves témoins pour les deux traitements (Fig. 2e). En utilisant une approche complémentaire pour quantifier la capacité d'un prédateur aviaire à distinguer deux stimuli23, nous constatons que les oiseaux ne seraient pas capables de distinguer les larves bandées des larves témoins, qu'elles soient élevées sur des goujons achromatiques (F1,127 = 2,64, P = 0,1 ; figure supplémentaire 1A) ou chromatiques (F1,169 = 1,01, P = 0,3 ; figures supplémentaires 1B et 2).
Fig. 2
figure2
B. Larves de B. betularia aveuglées et témoins B. larves de bétularia provenant de traitements achromatiques et chromatiques à l'aide de goujons. a Exemples de larves de contrôle (premier et troisième à partir de la gauche) et de larves de contrôle (deuxième et quatrième à partir de la gauche) du stade final de l'insecte, aveuglées, sur des chevilles noires et blanches b Luminance of larvae and dowels, calculée d'après une double capture dorsale de cône bleu, où BL = noir, W = blanc, D = cheville, C = larve témoin, et P = larve peint ou à l'oeil pliée. c Réflectance des larves noires et blanches (erreur moyenne et erreur type) et des goujons dans la gamme des longueurs d'onde visibles (300-700 nm, où noir = goujon noir (BLD), bleu = goujon blanc (WD), rouge = larve témoin noire (BLC : n = 29), vert = larve témoin noire (BLP : n = 45), jaune = larve témoin blanche (WC : n = 26) et magenta = larve témoin blanche (WP : n = 49). d Exemples d'un stade final les yeux bandés (deux à l'extérieur) et d'un contrôle (deux à l'intérieur)
larves sur des goujons de traitement bruns et verts. e " Verdissement " des larves et des goujons bruns et verts, calculé comme un rapport des prises de cônes de titrage bleu à ondes moyennes (MW) et à ondes longues (LW)[MW/(MW + LW)], où B = brun, G = vert, D = cheville, C = larve témoin et P = larve peint ou les yeux bandés. f Réflectance des larves brunes et vertes (erreur moyenne et erreur type) et des goujons, où noir = cheville brune (BD), bleu = cheville verte (GD), jaune = larve témoin brune (BC : n = 44), magenta = larve témoin brune (BP : n = 50), vert = larve témoin verte (GC : n = 36) et rouge = larve témoin verte (GP : n = 31). n = nombre de contrôles biologiques indépendants
Image pleine grandeur
Choix de l'arrière-plan
Afin d'évaluer davantage la capacité des chenilles B. betularia à percevoir les couleurs extraoculaires, nous avons testé le comportement du choix de l'arrière-plan à l'aide de deux modèles d'arrière-plan : un cube en plastique transparent contenant deux chevilles diagonalement croisées, chacune peinte d'une seule couleur (vert clair vs brun foncé) et un tube horizontal transparent avec une seule cheville suspendue horizontalement, une moitié peint en vert et une autre en brun (voir " Méthodes "). Ces deux conceptions nous ont permis de tester la cohérence du choix de l'arrière-plan dans des contextes différents. Pour chaque essai, les larves du dernier stade larvaire des groupes témoins et des groupes témoins des traitements vert et brun ont été placées à égale distance de chaque couleur de goujon. Comme le risque de prédation augmente la probabilité d'appariement du fond comportemental, nous avons simulé la prédation en piquant doucement les larves sur la surface dorsale à l'aide d'une pince à épiler (selon les méthodes décrites à la référence 24). Pour les chambres à goujons horizontales, afin d'éliminer toute préférence de position, deux essais ont été réalisés par larve. Dans un essai, l'extrémité brune de la cheville se trouvait à l'extrémité la plus éloignée de la chambre ; dans l'autre essai, la direction de la cheville était inversée (l'ordre des essais était aléatoire). Les larves individuelles ont été laissées pendant 12 h (7 h sombre, 5 h clair), après quoi la couleur de la cheville sur laquelle reposait chaque chenille a été enregistrée. Dans les deux types d'arénas (et dans les deux orientations de cheville dans l'aréna horizontal), les larves ont pu maximiser le camouflage en choisissant des couleurs de cheville qui correspondaient plus étroitement à leurs propres couleurs corporelles (figure 3). En moyenne, 75 à 80 % des larves brunes choisissent de se reposer sur une cheville brune, et 70 à 80 % des larves vertes choisissent de se reposer sur une cheville verte. Dans la conception de la chambre diagonale, il n'y avait aucun effet du bandeau (Z = -0,22, P = 0,83) ou de la couleur larvaire (Z = -0,87, P = 0,39) sur le succès de la comparaison. Dans la chambre horizontale, il n'y avait pas non plus d'effet du bandeau (Z = -1,24, P = 0,21), de la couleur des larves (Z = 0,82, P = 0,41) ou de la position des goujons (Z = -1,72, P = 0,08) sur le succès de la comparaison.
Fig. 3
figure3
Fréquence de la couleur de fond au repos choisie par les chenilles de B. betularia. Fréquence moyenne, en tant que proportions du stade final de B. betularia yeux bandés et chenilles témoins trouvées sur chaque couleur de goujon (luminance contrastante vert ou brun). Les larves individuelles issues d'expériences de bandage des yeux ont été placées dans des arènes diagonales (a) ou horizontales (b) et leur choix de repos a été enregistré après 12 h. La taille des échantillons (nombre de réplicats biologiquement indépendants) est, pour les expériences croisées de bandage (n = 60 et 34), respectivement : contrôle brun (n = 60 et 34), contrôle brun (n = 56 et 34), contrôle vert (n = 59 et 37) et bandeau vert (n = 51 et 32).
Image pleine grandeur
Expression visuelle des gènes
Pour étudier la base moléculaire des réponses morphologiques et comportementales, nous avons analysé l'expression de gènes clés impliqués dans la perception visuelle de la tête (y compris les yeux) et des tissus dermiques des larves et des adultes de B. betularia. Les opsines sont des protéines photosensibles qui médient la conversion d'un photon de lumière en un signal électrochimique, nécessaire à la vision et à la photoréception25. Nous avons identifié des opsines sensibles à l'ultraviolet (deux variantes d'épissage UVA et UVB), au bleu (deux variantes d'épissage BlA et BlB), aux grandes longueurs d'onde (deux copies de gènes LW1 et LW2) et à la mélanopsine (deux variantes d'épissage MelA et MelB) (figures supplémentaires 3-5). Nous avons également déterminé la séquence codante (CDS) de l'arrêt visuel-1 (Arr-1 ; Fig. 6 supplémentaire) et de la dégénérescence rétinienne B (RDB ; Fig. 7 supplémentaire), qui sont des composantes essentielles de la phototransplantation26,27. En utilisant la RT-PCR, nous avons détecté l'expression de ces gènes non seulement dans les yeux (tête), mais aussi dans tous les segments de l'épiderme du corps entier, tant chez les larves que chez les adultes (figure 4a, figure 8 supplémentaire). Des évaluations quantitatives ultérieures à l'aide de la RT-qPCR ont révélé que dans le tissu crânien, les niveaux d'expression de plusieurs des gènes testés sont des ordres de grandeur plus élevés chez les adultes que chez les larves (figure 4a ; t71 = -5,33, P < 0,0001). Cela reflète probablement la taille relative du composé par rapport aux yeux simples par rapport à la tête des deux étapes de la vie. L'expression des tissus dermiques pour tous les gènes, calculée en moyenne sur les trois segments du corps, est semblable chez les larves et les adultes (figure 4a ; t69 = -1,15, P = 0,26). Au cours des étapes de la vie,Chez les larves (Fig. 9A supplémentaire), l'expression de la RDB est plus élevée chez les classes et l'expression de la BlB est beaucoup plus faible dans l'abdomen ; chez les adultes (Fig. 9B supplémentaire), l'expression de la RDB est plus faible dans le segment génital et celle des UVA est légèrement supérieure dans le thorax.
Fig. 4
figure4
Expression visuelle des gènes dans la tête et les tissus dermiques aux stades larvaire (L) et adulte (A) de B. betularia. a Expression de neuf isoformes de gènes visuels par rapport à un gène témoin (spectrine) dans la tête (bleu clair) et les tissus corporels (bleu foncé). b Expression des mêmes gènes visuels dans la peau (bleu foncé) par rapport à la tête (bleu clair), calculée en[expression cutanée/(tête + expression dermique)]. Les barres indiquent les erreurs-types (n = 4 répétitions biologiquement indépendantes pour chaque étape). Noms de gènes : Arr-1 = arrestin-1, RDB = dégénérescence rétinienne B, UVA = isoforme A d'opsine sensible aux longueurs d'onde ultraviolette, BlA = isoforme A d'opsine sensible aux longueurs d'onde bleue, BlB = isoforme B d'opsine sensible aux longueurs d'onde bleue, MelA = isoforme A de mélanopsine, MelB = isoforme B de mélanopsine, LW1 = exemplaire un sensible aux opsine sensible aux longueurs d'onde longue et LW2 = deux exemplaires de l'opsine sensible aux longueurs d'onde longue
Image pleine grandeur
Le rapport entre l'expression des gènes dans l'épiderme et celle de la tête fournit une mesure de la contribution des photorécepteurs présumés dans l'épiderme larvaire à la capacité totale de détection de la lumière d'une chenille. Par cette mesure, l'expression dermique des gènes de photoréception est significativement plus élevée chez les larves que chez les adultes (Z11 = 0,22, P < 0,0001), LW2 étant le seul gène présentant une expression dermique relativement plus élevée chez les adultes (figure 4b). Chez les larves, l'expression de la RDB, de la BlB et de la LW1 est régulée à des niveaux similaires à ceux de la tête dans les tissus dermiques. Le contraste le plus fort dans l'expression dermique relative entre les larves et les adultes est pour Arr-1, BlB, MelB, et la copie 1 à grande longueur d'onde (LW1).
Discussion
Les larves de biston bétularia qui ont été empêchées de recevoir de la lumière par l'intermédiaire de leurs ocelles ont changé de couleur en réponse à la luminance et aux indices de couleur, et ont également maximisé les avantages de cette mascarade en plastique en sélectionnant activement des brindilles de même couleur. Les larves expérimentales et les larves témoins ont été tout aussi capables de changer d'apparence et de choisir le fond de repos approprié, démontrant qu'elles sont capables de photoréception extraoculaire spectralement sensible et impliquant que les ocelles jouent un rôle secondaire dans ces réponses. Nos résultats contrastent avec ceux d'expériences similaires sur le bandage des yeux dans d'autres arthropodes10,28, où les caractéristiques de la peinture ayant servi à bander les yeux, plutôt que la couleur de fond, changent de couleur. La nécessité d'une photoréception extraoculaire chez B. betularia peut être liée à la posture angulaire des larves des rameaux pendant la journée, ce qui éloigne les ocelles de la perchaude (Fig. 10 supplémentaire). Dans cette position, ainsi que pendant l'alimentation sur les feuilles, les photorécepteurs sur la peau larvaire peuvent recevoir des informations plus précises sur la couleur et le motif du rameau en repos que les ocelles.
Le rôle potentiel des photorécepteurs extraoculaires dans le changement de couleur par la production de pigments a d'abord été suggéré par Poulton15,29, qui a travaillé sur la détermination de la couleur des pupes chez A. urticae. Au moyen de chambres cloisonnées individuelles (c'est-à-dire sans occlusion ni destruction des ocelles), dans lesquelles la tête d'une larve et le reste du corps étaient exposés à des couleurs contrastées, il a montré que la couleur nymphale résultante était déterminée par la couleur de fond à laquelle avait été exposée la surface de la peau la plus étendue. Plus de cent ans plus tard, Kato et al.30 ont montré que la verdeur nymphal de la pyrale du chêne japonais, Antheraea yamamai, était déterminée par l'intensité de la lumière blanche et n'était pas affectée par la cautérisation des ocelles larvaires. Bien que de nombreuses autres espèces de chenilles changent de couleur pour mieux correspondre à leur état de repos31, aucune autre recherche sur les arthropodes n'a distingué le rôle des photorécepteurs oculaires des photorécepteurs extraoculaires.
La possibilité de choisir un arrière-plan de couleur assortie pourrait être considérée comme redondante chez les animaux qui changent de couleur, comme les chenilles de la pyrale poivrée, qui obtiennent une protection supplémentaire contre la prédation en se faisant passer pour des rameaux32. Cependant, comme le changement de couleur de B. betularia est un processus lent et que l'environnement de couleur des rameaux habités par ces chenilles est souvent hétérogène, le choix de l'arrière-plan offre une flexibilité et une réactivité accrues. La stratégie équivalente consistant à choisir de s'appuyer sur des arrière-plans assortis dans des environnements visuellement hétérogènes chez des espèces qui sont également capables de changer de couleur a évolué chez les poissons plats, les tritons larvaires et les salamandres33,34,35.
L'expression épidermique de l'opsine associée à la perception achromatique de la lumière a été signalée chez des cnidaires36, des céphalopodes37, des arthropodes38 et des vertébrés9. Compte tenu de ce que l'on sait de leur fonction principale et du coût énergétique de l'expression des gènes39, l'abondance relativement élevée d'une suite complète de phototransduction dans l'épiderme larvaire suggère qu'ils font partie de l'équipement photorécepteur extraoculaire. La question de savoir si c'est également le cas pour les papillons adultes, qui présentent également des niveaux appréciables d'expression génétique visuelle dans tous les segments de leur tissu épidermique, reste ouverte. On a signalé un appariement de fond précis pour les adultes d'un autre papillon géométrique40, mais les preuves de B. betularia, qui se présente sous forme d'une série mélanique de morphes génétiquement déterminés41, sont équivoques42. A notre connaissance, notre étude fournit les premières preuves de l'expression extraoculaire de l'opsine potentiellement capable de détecter la couleur chez un arthropode, liée à des changements fonctionnels d'apparence et de comportement.
L'identité et la localisation précise des photorécepteurs extraoculaires restent à déterminer. En se basant sur l'uniformité et le grain fin du changement de couleur (qui est un composite de différentes couches épidermiques ; Figure supplémentaire 11), ainsi que sur l'expression uniforme des gènes de phototransduction à travers les sections du corps, nous supposons qu'ils sont distribués plus ou moins uniformément dans une couche du derme larvaire, plutôt que dans quelques cellules spécialisées limitées en surface38. Des photorécepteurs extraoculaires, ressemblant à des cellules de phaosomes photosensibles dans la peau des vers de terre, ont été décrits dans les organes génitaux des papillons à queue d'aronde et proposés pour aider au choix du partenaire et à la ponte43. Alors que la réponse colorée des larves de B. betularia aveuglées pourrait, en principe, être produite par un mécanisme physiologique très cloisonné, le comportement d'appariement de fond suggère l'intégration d'informations diffuses de l'épiderme, non seulement sur les couleurs des rameaux mais aussi sur la ressemblance à soi. Il est donc probable que les systèmes nerveux et endocrinien jouent un rôle combiné dans le choix de la couleur et de l'arrière-plan.
Les profils d'expression des gènes visuels de B. betularia, associés à des preuves morphologiques et comportementales, nous amènent à proposer que les larves de B. betularia possèdent des photorécepteurs répartis sur l'épiderme. Leur fonction est de fournir des informations plus complètes sur la couleur et le motif que celles que l'on peut obtenir avec les ocelles seuls, non seulement sur le rameau au repos, mais aussi sur la correspondance entre soi et le rameau. La nature détaillée et composite de la gamme de couleurs de la chenille suggère une cascade complexe de traitement du signal qui initie, contrôle et coordonne la production de pigments multiples dans différents types de cellules. Nos résultats élargissent considérablement la vision actuelle du sens de la lumière dermique pour y inclure un lent changement de couleur, ce qui soulève des questions intrigantes sur la séquence évolutive du recrutement et de la modification des voies de pénétration qui a abouti à ce système sophistiqué de photoréception extraoculaire et de plasticité phénotypique, entraîné par une course aux armements évolutionnaire prédateurs-proies.
Méthodes
Expériences sur les chevilles
Élevage : Afin de tenir compte de tout effet génétique potentiel parmi les familles dans les réponses de la couleur des larves, les expériences sur les goujons ont été menées selon un modèle familial fractionné (tableau supplémentaire 1). Les bétulariums bistonnaires ont été élevés à partir d'œufs et pourvus de saule de chèvre (Salix caprea) ad libitum, avec des feuilles sur les branches et en l'absence de chevilles artificielles. Au deuxième stade, avant toute forte réaction d'appariement des couleurs (Fig. 12 supplémentaire), 25 larves ont été transférées dans chaque arène de traitement. Les arénas de traitement se composent de boîtes en plastique transparent mesurant 279 × 159 × 102 mm (longueur × largeur × profondeur × profondeur) garnies d'un essuie-tout uni bleu plié en C, chaque boîte contenant des chevilles en bois de 20 × 12 cm de longueur (10 × 5 mm de diamètre et 10 × 3 mm de diamètre) maintenues en place par un grillage en grillage peint en fonction des couleurs des chevilles utilisées pour chaque expérience (figures supplémentaires 13 et 14, tableau supplémentaire 1). Les larves ont été nourries avec des feuilles de S. caprea arrachées des branches et des tiges ad libitum et les boîtes ont été lavées avec 10% d'eau de Javel tous les trois jours pour réduire le risque d'infection. Les boîtes de traitement ont été maintenues à 20 cm les unes des autres dans une chambre d'essai polyvalente Sanyo (modèle MLR-351), avec un cycle jour/nuit de 12:12 h, à 24 °C le jour, la luminescence étant réglée à 15 000 lx et à 18 °C la nuit pendant toute la durée de l'expérience, jusqu'à la pupe.
Bander les yeux : Après une étude pilote, la peinture acrylique noire (Peinture acrylique essentielle Royal Langnickel PNTA158 NOIR) a été choisie comme la méthode la plus appropriée pour occlure la lumière des ocelles et appliquée à l'aide d'une brosse de détail Royal Langnickel Sable Hair (Liner 5/0,0), au moyen d'un microscope. La peinture ne permettait pas la transmission de la lumière (Fig. 15 supplémentaire). Les larves ont été examinées deux fois par jour pour déceler tout signe de glissement de la capsule de la tête. Les personnes présentant des signes de glissement de la capsule de la tête ont été retirées de l'arène de traitement et placées dans de petites boîtes en plastique (70 mm × 70 mm de base × 50 mm de hauteur) recouvertes d'un carton blanc opaque, ne contenant que du matériel alimentaire (aucune cheville sur laquelle reposer). Ce traitement a éliminé le stimulus de la cheville tout en maintenant le rythme normal jour/nuit.
Après un glissement complet de la capsule de la tête, les ocelles de ces personnes ont été repeints de nouveau et remis dans l'aréna où ils avaient été traités. Le temps maximum pour un glissement complet de la capsule de la tête du début à la fin est de 24 h44. Dans cette expérience, le glissement de la capsule de la tête était habituellement terminé 6 à 12 heures après l'enlèvement des larves des goujons. De cette façon, il n'y avait aucun point où les ocelles du groupe aux yeux bandés auraient pu recevoir de l'information visuelle sur les goujons. Les larves témoins n'ont pas été peintes ni transférées dans des boîtes d'isolement. L'ablation partielle du bandeau n'a été observée que deux fois sur un total de 11 480 contrôles dans toutes les expériences ; ces individus ont été retirés de l'expérience.
Quantification de la réponse de la couleur : La quantification et l'analyse de la couleur ont été effectuées comme décrit dans la référence20. La réflectance des larves du stade larvaire final et des goujons peints a été mesurée à l'aide d'un spectrophotomètre Ocean Optics USB2000, avec une source lumineuse halogène au deutérium DH-2000 et mesurée par rapport à une norme de réflectance WS-1. Les larves ont été refroidies dans un réfrigérateur pendant 2 à 10 minutes avant la mesure pour réduire les mouvements. Au total, six mesures ont été effectuées : trois à partir de la surface latérale gauche et trois à partir de la surface latérale droite de chaque individu, toujours enregistrées à partir du troisième segment thoracique et des deuxième et sixième segments abdominal. Ceci afin d'éviter le chevauchement des mesures et parce que ces segments ne présentaient pas de marques proéminentes. Toutes les données de spectrométrie ont été enregistrées avec Overture v.1.0.1.
Nous avons traité les spectres à des intervalles de 1 nm dans le spectre de la lumière visible (300-700) à l'aide d'un programme MATLAB (fourni par I. C. Cuthill), et modélisé la vision dans l'espace couleur aviaire à l'aide de photons coniques pris dans la mésange bleue, Cyanistes caerulus22. Les valeurs de stimulation des cônes ont été converties en coordonnées cartésiennes et tracées dans un espace tétraédrique à l'aide d'un script MATLAB personnalisé45, de sorte que chaque cône est représenté par un axe. Cet espace colorimétrique est utile parce que si une couleur ne stimule qu'un seul type de cône, ses coordonnées se trouvent à l'extrémité appropriée du tétraèdre, et lorsque les quatre types de cônes sont également stimulés, ses coordonnées se trouvent à l'origine (figure 2 supplémentaire).
Pour fournir une mesure plus simple de la couleur, nous avons calculé la verdeur comme étant le rapport entre les valeurs de capture du cône des photorécepteurs de longueur d'onde moyenne et de longue longueur d'onde[MW/(MW + LW)], qui représentent les mécanismes opposés, en suivant Arenas et Stevens46. Pour l'expérience des goujons en noir et blanc, nous avons modélisé la réponse à la luminance mais pas à la couleur. Nous n'avons donc analysé que la prise du cône DD de titrage bleu, car ces cônes médient la vision de luminance22,47.
Nous avons modélisé la facilité avec laquelle un prédateur aviaire pourrait faire la distinction entre les goujons et les larves à l'aide du JND ; pour les mathématiques, voir Vorobyev et Osorio23. Pour les contrastes chromatiques, nous avons utilisé les sensibilités spectrales du titrage bleu à travers des rapports de cônes relatifs de SW = 0,7111 ; MW = 0,9926 ; LW = 1,0 ; et UV = 0,370448, avec une fraction Weber de 0,05 et une irradiance idéalisée (D65). Pour modéliser les JND de luminance, nous avons utilisé des cônes DD de titrage bleu. JND < 1,00 indiquent que deux stimuli sont indiscernables ; les stimuli différant de 1 à 3 unités JND ne sont discriminables que dans de bonnes conditions d'observation ; les stimuli présentant des valeurs supérieures devraient pouvoir être distingués avec une facilité croissante49.
Choix du microhabitat : Les larves qui avaient été élevées sur des chevrons bruns et verts ont été placées dans deux chambres de choix : l'une avec un choix de deux chevrons croisés en diagonale et l'autre avec un seul cheville horizontal. La raison d'être de l'utilisation de deux modèles était de tester les larves dans des conditions de départ différentes, ce qui peut produire des réponses d'échappement initiales non sélectives (sur tout rameau lorsque la larve est placée sur une surface plane). Toutes les expériences de microhabitat ont été menées sur 12 individus à la fois dans une chambre d'essai polyvalente Sanyo (modèle MLR-351) au niveau de lumière 4 (15 000 lx).
La chambre diagonale de choix de l'habitat se composait d'un cube de plastique transparent mesurant 70 × 70 × 80 mm (longueur × largeur × profondeur, y compris le couvercle) et contenant deux goujons diagonalement croisés de 100 mm de long peints dans les couleurs contrastantes (brun ou vert) sur lesquelles les larves étaient élevées lors des expériences avec bandeau (figure supplémentaire 16A). Des larves individuelles ont été placées à égale distance de chaque cheville sur la base des boîtiers diagonaux des goujons. Avant la mise en place, les larves ont été légèrement piquées à l'aide d'une pince à épiler trois fois le long de la surface dorsale pour simuler la prédation, car le risque de prédation augmente la probabilité de choix du microhabitat24. Un autocollant avec l'identification des larves a été apposé sur le côté de chaque chambre. Les individus ont été laissés pendant 12 h (7 h de lumière sombre et 5 h de lumière, choisies pour réduire la perturbation du rythme circadien naturel des larves), après quoi la couleur de la cheville sur laquelle reposait chaque chenille a été enregistrée, suivie de l'ID de larve. Un enregistrement a été effectué par larve.
désolé je n'ai pas tout traduit...
Après la quantité importante d'articles à charge sur les Ummo ainsi que son dénigrement en règle des "suiveurs", que change cette info ?
Un article de NATURE vient dévoiler cette capacité étonnante d'une chenille qui lui permet d'adapter sa couleur à son environnement.
Quel rapport avec les Ummites ? Dans la lettre D99, ils affirment percevoir les couleurs avec leurs doigts ainsi que leur poignet.

Traduction Deepl pour les non anglicistes. Attention: très long article scientifique.
Le changement adaptatif de couleur et le comportement de choix de l'arrière-plan chez la chenille de la tordeuse poivrée sont remédiés par la photoréception extra-oculaire.
Amy Eacock, Hannah M. Rowland, Arjen E. van't Hof, Carl J. Yung, Nicola Edmonds & Ilik J. Saccheri
Communications Biology volume 2, Article : 286 (2019) | Télécharger Citation
Paramètres de l'article
Résumé
La détection de la lumière par les tissus distincts de l'œil se produit dans divers groupes d'animaux, ce qui permet un contrôle circadien et un comportement phototactique. Les photorécepteurs extraoculaires peuvent également faciliter un changement de couleur rapide chez les céphalopodes et les lézards, mais on en sait peu sur le système sensoriel qui intervient dans le changement de couleur lent des arthropodes. Nous avons déjà signalé que le lent changement de couleur des chenilles imitant les chenilles des brindilles de la pyrale poivrée (Biston betularia) est une réponse aux repères visuels achromatiques et chromatiques. Nous montrons ici que la perception de ces signaux, et les réponses phénotypiques qui en résultent, ne nécessitent pas de vision oculaire. Les chenilles à ocelles complètement obscurcis sont restées capables d'améliorer leur crypsis en changeant de couleur et en choisissant de se reposer sur des rameaux de couleur assortie. Une suite de gènes visuels, exprimés à travers le tégument larvaire, joue probablement un rôle clé dans le mécanisme. À notre connaissance, il s'agit de la première preuve que la détection extraoculaire de la couleur peut médier le changement de couleur et le comportement des pigments chez un arthropode.
Introduction
La photoréception cutanée, c'est-à-dire la capacité de percevoir l'information photique à travers la peau indépendamment des yeux, a évolué un certain nombre de fois pour servir une variété de fonctions1,2,3,4. Elle est surtout connue pour son implication dans les réflexes d'ombre, la phototaxie et l'orientation en réponse à la lumière5. Plus récemment, on a proposé que la photoréception cutanée (plus généralement appelée photoréception extraoculaire) serve de médiateur pour le changement rapide (physiologique) de couleur observé chez les céphalopodes6,7, les poissons8 et les reptiles9, par le réarrangement des granules de pigment ou des plaquettes réfléchissantes dans des cellules spécialisées appelées chromatophores. Un changement de couleur lent (morphologique), se produisant sur des heures ou des semaines, est fréquent chez les arthropodes10,11. Plusieurs études ont démontré que les caractéristiques du substrat12 et la longueur d'onde de la lumière13 influencent la couleur de la nymphe chez une variété d'espèces de papillons14, en supposant qu'ils utilisent leurs yeux pour percevoir les stimuli de couleur. Des expériences pionnières menées par l'entomologiste victorien Edward Bagnall Poulton sur le contrôle de la couleur des nymphes du petit papillon écaille, Aglais urticae, ont été les premières à mettre en évidence une photoréception extraoculaire chez les arthropodes à changement de couleur15. Ce n'est que récemment que les chercheurs ont réexaminé la possibilité que la photoréception extraoculaire soit impliquée dans le lent changement de couleur des arthopodes16. Étant donné la prévalence d'un changement de couleur lent, des recherches sont nécessaires pour examiner l'importance de la photoréception extraoculaire dans cette catégorie de changement de couleur et pour caractériser la base physiologique de ce phénomène biologique sous-exploré.
Le papillon poivré (Biston betularia) a évolué pour devenir un prédateur très cryptique pour les prédateurs visuels, tant au stade adulte que larvaire. La crypsis est obtenue par des mécanismes contrastés à chaque étape. Le polymorphisme (mélanisme) du motif coloré adulte est déterminé génétiquement17,18, tandis que les larves se camouflent grâce à une combinaison de mascarade imitant les brindilles19 et de plasticité de la couleur20. Le changement de couleur de ces larves polyphages est une norme de réaction continue en réponse à des indices de couleur provenant des rameaux dans l'environnement immédiat des larves plutôt que des feuilles qu'elles mangent20. La précision de cette réponse de couleur et de motif est en désaccord avec la simple larve ocelli21 et la position distale de la tête par rapport au rameau lorsque les larves sont en position de repos. Nous avons supposé que les larves pourraient utiliser un sens visuel supplémentaire. Nous présentons ici les résultats d'expériences morphologiques, comportementales et d'expression génique visant à étudier le rôle de la photoréception extraoculaire chez les larves de B. betularia qui changent de couleur.
Nous avons élevé 321 larves de 4 familles en groupes répliqués de 25 individus, à l'intérieur de boîtes en plastique transparent contenant des rameaux artificiels entrecroisés (chevilles peintes), sur des feuilles fraîches sans pédoncule du saule gris, Salix cinerea (voir'Méthodes'). Nous avons peint les ocelles des chenilles avec de la peinture acrylique noire à l'aide d'un microscope (Fig. 1). Cette obstruction de la vision oculaire ou'bandage des yeux' a commencé à la fin du deuxième au début du troisième stade, qui est le stade le plus précoce auquel les larves peuvent être effectivement bandés les yeux, et précède une forte réponse colorée. Pour surmonter le problème des chenilles qui perdent leur bandeau dans le processus de mue entre les stades, nous avons vérifié les chenilles deux fois par jour pour déceler les premiers signes de glissement des capsules de la tête. Le glissement de la capsule de la tête prend environ 12 à 18 heures, pendant lesquelles nous avons tenu ces personnes séparément et individuellement toute la nuit dans des boîtes blanches opaques sans aucun goujon. De la peinture fraîche a été appliquée sur la nouvelle capsule de tête, empêchant ainsi les chenilles de recevoir un signal de couleur de goujon, et les chenilles ont été retournées dans leur compartiment de groupe. Nous avons utilisé quatre couleurs de chevilles différentes, avec une couleur par boîtier : brun, vert, noir et blanc (voir'Méthodes'). La première paire de couleurs différait en chroma et luminance ; la seconde paire différait seulement en luminance. La réflectance spectrale du tégument de chaque chenille a été mesurée au stade final (sixième) à l'aide d'un spectrophotomètre (six mesures sans chevauchement). Nous avons utilisé un modèle informatique de la perception visuelle pour quantifier la couleur et la luminance des larves telles qu'elles seraient perçues par un prédateur aviaire, la mésange bleue, Cyanistes caeruleus22. Nous avons calculé comment les chenilles vertes apparaissaient à un prédateur comme le rapport des réponses des cônes de longueur d'onde moyenne et longue, la luminance de chaque chenille comme les réponses des cônes double dorsal (DD) et la discriminabilité des larves comme des unités de " différences simplement perceptibles (JND) " (voir " Méthodes ").
Fig. 1
figure1
B. chenille de contrôle de B. betularia montrant un anneau de cinq ocelles encerclés en jaune et un sixième ocelle ventral encerclé séparément. b Exemple d'une larve de stade final avec ocelles masqués par de la peinture acrylique noire opaque. La barre d'échelle représente 1 mm
Image pleine grandeur
Résultats
Changement de couleur
Nous avons constaté un changement frappant de la couleur de l'ensemble du corps en l'absence d'information visuelle des yeux, ce qui fait que les chenilles ont non seulement changé de couleur pour ressembler à la couleur des goujons dans leur enclos, mais elles l'ont fait au même degré que les témoins non aveuglés. Ceci est évident pour l'œil humain (Fig. 2a, d), ainsi que par la comparaison des courbes de réflectance spectrale dans la gamme des longueurs d'onde visibles (Fig. 2c, e). Cependant, l'évaluation la plus critique et la plus pertinente sur le plan écologique se fait à travers le prisme de la perception d'un prédateur aviaire, que nous avons quantifiée par modélisation psychophysique. Vu à travers cette lentille, les larves de B. betularia élevées dans des enclos de goujons blancs étaient significativement plus brillantes que celles élevées sur des chevrons noirs, lorsqu'elles étaient mesurées comme les réponses à double cône de la rétine aviaire (F1,127 = 177,4, P < 0,0001 ; figure 2b), mais aucun effet significatif du bandé des yeux sur la luminance de la larve des traitements noir ou blanc (F1,127 = 0,28, P = 0,6). Les larves élevées dans des enclos de chevilles vertes étaient significativement plus vertes pour un prédateur aviaire que les larves issues de traitements bruns (F1,169 = 451.2, P < 0.0001 ; Fig. 2e). De plus, le fait de bander les yeux n'a pas eu d'effet significatif sur le verdissement des larves dans les traitements vert ou brun (F1,169 = 0,67, P = 0,4), et la distribution du verdissement était semblable entre les larves aveuglées et les larves témoins pour les deux traitements (Fig. 2e). En utilisant une approche complémentaire pour quantifier la capacité d'un prédateur aviaire à distinguer deux stimuli23, nous constatons que les oiseaux ne seraient pas capables de distinguer les larves bandées des larves témoins, qu'elles soient élevées sur des goujons achromatiques (F1,127 = 2,64, P = 0,1 ; figure supplémentaire 1A) ou chromatiques (F1,169 = 1,01, P = 0,3 ; figures supplémentaires 1B et 2).
Fig. 2
figure2
B. Larves de B. betularia aveuglées et témoins B. larves de bétularia provenant de traitements achromatiques et chromatiques à l'aide de goujons. a Exemples de larves de contrôle (premier et troisième à partir de la gauche) et de larves de contrôle (deuxième et quatrième à partir de la gauche) du stade final de l'insecte, aveuglées, sur des chevilles noires et blanches b Luminance of larvae and dowels, calculée d'après une double capture dorsale de cône bleu, où BL = noir, W = blanc, D = cheville, C = larve témoin, et P = larve peint ou à l'oeil pliée. c Réflectance des larves noires et blanches (erreur moyenne et erreur type) et des goujons dans la gamme des longueurs d'onde visibles (300-700 nm, où noir = goujon noir (BLD), bleu = goujon blanc (WD), rouge = larve témoin noire (BLC : n = 29), vert = larve témoin noire (BLP : n = 45), jaune = larve témoin blanche (WC : n = 26) et magenta = larve témoin blanche (WP : n = 49). d Exemples d'un stade final les yeux bandés (deux à l'extérieur) et d'un contrôle (deux à l'intérieur)
larves sur des goujons de traitement bruns et verts. e " Verdissement " des larves et des goujons bruns et verts, calculé comme un rapport des prises de cônes de titrage bleu à ondes moyennes (MW) et à ondes longues (LW)[MW/(MW + LW)], où B = brun, G = vert, D = cheville, C = larve témoin et P = larve peint ou les yeux bandés. f Réflectance des larves brunes et vertes (erreur moyenne et erreur type) et des goujons, où noir = cheville brune (BD), bleu = cheville verte (GD), jaune = larve témoin brune (BC : n = 44), magenta = larve témoin brune (BP : n = 50), vert = larve témoin verte (GC : n = 36) et rouge = larve témoin verte (GP : n = 31). n = nombre de contrôles biologiques indépendants
Image pleine grandeur
Choix de l'arrière-plan
Afin d'évaluer davantage la capacité des chenilles B. betularia à percevoir les couleurs extraoculaires, nous avons testé le comportement du choix de l'arrière-plan à l'aide de deux modèles d'arrière-plan : un cube en plastique transparent contenant deux chevilles diagonalement croisées, chacune peinte d'une seule couleur (vert clair vs brun foncé) et un tube horizontal transparent avec une seule cheville suspendue horizontalement, une moitié peint en vert et une autre en brun (voir " Méthodes "). Ces deux conceptions nous ont permis de tester la cohérence du choix de l'arrière-plan dans des contextes différents. Pour chaque essai, les larves du dernier stade larvaire des groupes témoins et des groupes témoins des traitements vert et brun ont été placées à égale distance de chaque couleur de goujon. Comme le risque de prédation augmente la probabilité d'appariement du fond comportemental, nous avons simulé la prédation en piquant doucement les larves sur la surface dorsale à l'aide d'une pince à épiler (selon les méthodes décrites à la référence 24). Pour les chambres à goujons horizontales, afin d'éliminer toute préférence de position, deux essais ont été réalisés par larve. Dans un essai, l'extrémité brune de la cheville se trouvait à l'extrémité la plus éloignée de la chambre ; dans l'autre essai, la direction de la cheville était inversée (l'ordre des essais était aléatoire). Les larves individuelles ont été laissées pendant 12 h (7 h sombre, 5 h clair), après quoi la couleur de la cheville sur laquelle reposait chaque chenille a été enregistrée. Dans les deux types d'arénas (et dans les deux orientations de cheville dans l'aréna horizontal), les larves ont pu maximiser le camouflage en choisissant des couleurs de cheville qui correspondaient plus étroitement à leurs propres couleurs corporelles (figure 3). En moyenne, 75 à 80 % des larves brunes choisissent de se reposer sur une cheville brune, et 70 à 80 % des larves vertes choisissent de se reposer sur une cheville verte. Dans la conception de la chambre diagonale, il n'y avait aucun effet du bandeau (Z = -0,22, P = 0,83) ou de la couleur larvaire (Z = -0,87, P = 0,39) sur le succès de la comparaison. Dans la chambre horizontale, il n'y avait pas non plus d'effet du bandeau (Z = -1,24, P = 0,21), de la couleur des larves (Z = 0,82, P = 0,41) ou de la position des goujons (Z = -1,72, P = 0,08) sur le succès de la comparaison.
Fig. 3
figure3
Fréquence de la couleur de fond au repos choisie par les chenilles de B. betularia. Fréquence moyenne, en tant que proportions du stade final de B. betularia yeux bandés et chenilles témoins trouvées sur chaque couleur de goujon (luminance contrastante vert ou brun). Les larves individuelles issues d'expériences de bandage des yeux ont été placées dans des arènes diagonales (a) ou horizontales (b) et leur choix de repos a été enregistré après 12 h. La taille des échantillons (nombre de réplicats biologiquement indépendants) est, pour les expériences croisées de bandage (n = 60 et 34), respectivement : contrôle brun (n = 60 et 34), contrôle brun (n = 56 et 34), contrôle vert (n = 59 et 37) et bandeau vert (n = 51 et 32).
Image pleine grandeur
Expression visuelle des gènes
Pour étudier la base moléculaire des réponses morphologiques et comportementales, nous avons analysé l'expression de gènes clés impliqués dans la perception visuelle de la tête (y compris les yeux) et des tissus dermiques des larves et des adultes de B. betularia. Les opsines sont des protéines photosensibles qui médient la conversion d'un photon de lumière en un signal électrochimique, nécessaire à la vision et à la photoréception25. Nous avons identifié des opsines sensibles à l'ultraviolet (deux variantes d'épissage UVA et UVB), au bleu (deux variantes d'épissage BlA et BlB), aux grandes longueurs d'onde (deux copies de gènes LW1 et LW2) et à la mélanopsine (deux variantes d'épissage MelA et MelB) (figures supplémentaires 3-5). Nous avons également déterminé la séquence codante (CDS) de l'arrêt visuel-1 (Arr-1 ; Fig. 6 supplémentaire) et de la dégénérescence rétinienne B (RDB ; Fig. 7 supplémentaire), qui sont des composantes essentielles de la phototransplantation26,27. En utilisant la RT-PCR, nous avons détecté l'expression de ces gènes non seulement dans les yeux (tête), mais aussi dans tous les segments de l'épiderme du corps entier, tant chez les larves que chez les adultes (figure 4a, figure 8 supplémentaire). Des évaluations quantitatives ultérieures à l'aide de la RT-qPCR ont révélé que dans le tissu crânien, les niveaux d'expression de plusieurs des gènes testés sont des ordres de grandeur plus élevés chez les adultes que chez les larves (figure 4a ; t71 = -5,33, P < 0,0001). Cela reflète probablement la taille relative du composé par rapport aux yeux simples par rapport à la tête des deux étapes de la vie. L'expression des tissus dermiques pour tous les gènes, calculée en moyenne sur les trois segments du corps, est semblable chez les larves et les adultes (figure 4a ; t69 = -1,15, P = 0,26). Au cours des étapes de la vie,Chez les larves (Fig. 9A supplémentaire), l'expression de la RDB est plus élevée chez les classes et l'expression de la BlB est beaucoup plus faible dans l'abdomen ; chez les adultes (Fig. 9B supplémentaire), l'expression de la RDB est plus faible dans le segment génital et celle des UVA est légèrement supérieure dans le thorax.
Fig. 4
figure4
Expression visuelle des gènes dans la tête et les tissus dermiques aux stades larvaire (L) et adulte (A) de B. betularia. a Expression de neuf isoformes de gènes visuels par rapport à un gène témoin (spectrine) dans la tête (bleu clair) et les tissus corporels (bleu foncé). b Expression des mêmes gènes visuels dans la peau (bleu foncé) par rapport à la tête (bleu clair), calculée en[expression cutanée/(tête + expression dermique)]. Les barres indiquent les erreurs-types (n = 4 répétitions biologiquement indépendantes pour chaque étape). Noms de gènes : Arr-1 = arrestin-1, RDB = dégénérescence rétinienne B, UVA = isoforme A d'opsine sensible aux longueurs d'onde ultraviolette, BlA = isoforme A d'opsine sensible aux longueurs d'onde bleue, BlB = isoforme B d'opsine sensible aux longueurs d'onde bleue, MelA = isoforme A de mélanopsine, MelB = isoforme B de mélanopsine, LW1 = exemplaire un sensible aux opsine sensible aux longueurs d'onde longue et LW2 = deux exemplaires de l'opsine sensible aux longueurs d'onde longue
Image pleine grandeur
Le rapport entre l'expression des gènes dans l'épiderme et celle de la tête fournit une mesure de la contribution des photorécepteurs présumés dans l'épiderme larvaire à la capacité totale de détection de la lumière d'une chenille. Par cette mesure, l'expression dermique des gènes de photoréception est significativement plus élevée chez les larves que chez les adultes (Z11 = 0,22, P < 0,0001), LW2 étant le seul gène présentant une expression dermique relativement plus élevée chez les adultes (figure 4b). Chez les larves, l'expression de la RDB, de la BlB et de la LW1 est régulée à des niveaux similaires à ceux de la tête dans les tissus dermiques. Le contraste le plus fort dans l'expression dermique relative entre les larves et les adultes est pour Arr-1, BlB, MelB, et la copie 1 à grande longueur d'onde (LW1).
Discussion
Les larves de biston bétularia qui ont été empêchées de recevoir de la lumière par l'intermédiaire de leurs ocelles ont changé de couleur en réponse à la luminance et aux indices de couleur, et ont également maximisé les avantages de cette mascarade en plastique en sélectionnant activement des brindilles de même couleur. Les larves expérimentales et les larves témoins ont été tout aussi capables de changer d'apparence et de choisir le fond de repos approprié, démontrant qu'elles sont capables de photoréception extraoculaire spectralement sensible et impliquant que les ocelles jouent un rôle secondaire dans ces réponses. Nos résultats contrastent avec ceux d'expériences similaires sur le bandage des yeux dans d'autres arthropodes10,28, où les caractéristiques de la peinture ayant servi à bander les yeux, plutôt que la couleur de fond, changent de couleur. La nécessité d'une photoréception extraoculaire chez B. betularia peut être liée à la posture angulaire des larves des rameaux pendant la journée, ce qui éloigne les ocelles de la perchaude (Fig. 10 supplémentaire). Dans cette position, ainsi que pendant l'alimentation sur les feuilles, les photorécepteurs sur la peau larvaire peuvent recevoir des informations plus précises sur la couleur et le motif du rameau en repos que les ocelles.
Le rôle potentiel des photorécepteurs extraoculaires dans le changement de couleur par la production de pigments a d'abord été suggéré par Poulton15,29, qui a travaillé sur la détermination de la couleur des pupes chez A. urticae. Au moyen de chambres cloisonnées individuelles (c'est-à-dire sans occlusion ni destruction des ocelles), dans lesquelles la tête d'une larve et le reste du corps étaient exposés à des couleurs contrastées, il a montré que la couleur nymphale résultante était déterminée par la couleur de fond à laquelle avait été exposée la surface de la peau la plus étendue. Plus de cent ans plus tard, Kato et al.30 ont montré que la verdeur nymphal de la pyrale du chêne japonais, Antheraea yamamai, était déterminée par l'intensité de la lumière blanche et n'était pas affectée par la cautérisation des ocelles larvaires. Bien que de nombreuses autres espèces de chenilles changent de couleur pour mieux correspondre à leur état de repos31, aucune autre recherche sur les arthropodes n'a distingué le rôle des photorécepteurs oculaires des photorécepteurs extraoculaires.
La possibilité de choisir un arrière-plan de couleur assortie pourrait être considérée comme redondante chez les animaux qui changent de couleur, comme les chenilles de la pyrale poivrée, qui obtiennent une protection supplémentaire contre la prédation en se faisant passer pour des rameaux32. Cependant, comme le changement de couleur de B. betularia est un processus lent et que l'environnement de couleur des rameaux habités par ces chenilles est souvent hétérogène, le choix de l'arrière-plan offre une flexibilité et une réactivité accrues. La stratégie équivalente consistant à choisir de s'appuyer sur des arrière-plans assortis dans des environnements visuellement hétérogènes chez des espèces qui sont également capables de changer de couleur a évolué chez les poissons plats, les tritons larvaires et les salamandres33,34,35.
L'expression épidermique de l'opsine associée à la perception achromatique de la lumière a été signalée chez des cnidaires36, des céphalopodes37, des arthropodes38 et des vertébrés9. Compte tenu de ce que l'on sait de leur fonction principale et du coût énergétique de l'expression des gènes39, l'abondance relativement élevée d'une suite complète de phototransduction dans l'épiderme larvaire suggère qu'ils font partie de l'équipement photorécepteur extraoculaire. La question de savoir si c'est également le cas pour les papillons adultes, qui présentent également des niveaux appréciables d'expression génétique visuelle dans tous les segments de leur tissu épidermique, reste ouverte. On a signalé un appariement de fond précis pour les adultes d'un autre papillon géométrique40, mais les preuves de B. betularia, qui se présente sous forme d'une série mélanique de morphes génétiquement déterminés41, sont équivoques42. A notre connaissance, notre étude fournit les premières preuves de l'expression extraoculaire de l'opsine potentiellement capable de détecter la couleur chez un arthropode, liée à des changements fonctionnels d'apparence et de comportement.
L'identité et la localisation précise des photorécepteurs extraoculaires restent à déterminer. En se basant sur l'uniformité et le grain fin du changement de couleur (qui est un composite de différentes couches épidermiques ; Figure supplémentaire 11), ainsi que sur l'expression uniforme des gènes de phototransduction à travers les sections du corps, nous supposons qu'ils sont distribués plus ou moins uniformément dans une couche du derme larvaire, plutôt que dans quelques cellules spécialisées limitées en surface38. Des photorécepteurs extraoculaires, ressemblant à des cellules de phaosomes photosensibles dans la peau des vers de terre, ont été décrits dans les organes génitaux des papillons à queue d'aronde et proposés pour aider au choix du partenaire et à la ponte43. Alors que la réponse colorée des larves de B. betularia aveuglées pourrait, en principe, être produite par un mécanisme physiologique très cloisonné, le comportement d'appariement de fond suggère l'intégration d'informations diffuses de l'épiderme, non seulement sur les couleurs des rameaux mais aussi sur la ressemblance à soi. Il est donc probable que les systèmes nerveux et endocrinien jouent un rôle combiné dans le choix de la couleur et de l'arrière-plan.
Les profils d'expression des gènes visuels de B. betularia, associés à des preuves morphologiques et comportementales, nous amènent à proposer que les larves de B. betularia possèdent des photorécepteurs répartis sur l'épiderme. Leur fonction est de fournir des informations plus complètes sur la couleur et le motif que celles que l'on peut obtenir avec les ocelles seuls, non seulement sur le rameau au repos, mais aussi sur la correspondance entre soi et le rameau. La nature détaillée et composite de la gamme de couleurs de la chenille suggère une cascade complexe de traitement du signal qui initie, contrôle et coordonne la production de pigments multiples dans différents types de cellules. Nos résultats élargissent considérablement la vision actuelle du sens de la lumière dermique pour y inclure un lent changement de couleur, ce qui soulève des questions intrigantes sur la séquence évolutive du recrutement et de la modification des voies de pénétration qui a abouti à ce système sophistiqué de photoréception extraoculaire et de plasticité phénotypique, entraîné par une course aux armements évolutionnaire prédateurs-proies.
Méthodes
Expériences sur les chevilles
Élevage : Afin de tenir compte de tout effet génétique potentiel parmi les familles dans les réponses de la couleur des larves, les expériences sur les goujons ont été menées selon un modèle familial fractionné (tableau supplémentaire 1). Les bétulariums bistonnaires ont été élevés à partir d'œufs et pourvus de saule de chèvre (Salix caprea) ad libitum, avec des feuilles sur les branches et en l'absence de chevilles artificielles. Au deuxième stade, avant toute forte réaction d'appariement des couleurs (Fig. 12 supplémentaire), 25 larves ont été transférées dans chaque arène de traitement. Les arénas de traitement se composent de boîtes en plastique transparent mesurant 279 × 159 × 102 mm (longueur × largeur × profondeur × profondeur) garnies d'un essuie-tout uni bleu plié en C, chaque boîte contenant des chevilles en bois de 20 × 12 cm de longueur (10 × 5 mm de diamètre et 10 × 3 mm de diamètre) maintenues en place par un grillage en grillage peint en fonction des couleurs des chevilles utilisées pour chaque expérience (figures supplémentaires 13 et 14, tableau supplémentaire 1). Les larves ont été nourries avec des feuilles de S. caprea arrachées des branches et des tiges ad libitum et les boîtes ont été lavées avec 10% d'eau de Javel tous les trois jours pour réduire le risque d'infection. Les boîtes de traitement ont été maintenues à 20 cm les unes des autres dans une chambre d'essai polyvalente Sanyo (modèle MLR-351), avec un cycle jour/nuit de 12:12 h, à 24 °C le jour, la luminescence étant réglée à 15 000 lx et à 18 °C la nuit pendant toute la durée de l'expérience, jusqu'à la pupe.
Bander les yeux : Après une étude pilote, la peinture acrylique noire (Peinture acrylique essentielle Royal Langnickel PNTA158 NOIR) a été choisie comme la méthode la plus appropriée pour occlure la lumière des ocelles et appliquée à l'aide d'une brosse de détail Royal Langnickel Sable Hair (Liner 5/0,0), au moyen d'un microscope. La peinture ne permettait pas la transmission de la lumière (Fig. 15 supplémentaire). Les larves ont été examinées deux fois par jour pour déceler tout signe de glissement de la capsule de la tête. Les personnes présentant des signes de glissement de la capsule de la tête ont été retirées de l'arène de traitement et placées dans de petites boîtes en plastique (70 mm × 70 mm de base × 50 mm de hauteur) recouvertes d'un carton blanc opaque, ne contenant que du matériel alimentaire (aucune cheville sur laquelle reposer). Ce traitement a éliminé le stimulus de la cheville tout en maintenant le rythme normal jour/nuit.
Après un glissement complet de la capsule de la tête, les ocelles de ces personnes ont été repeints de nouveau et remis dans l'aréna où ils avaient été traités. Le temps maximum pour un glissement complet de la capsule de la tête du début à la fin est de 24 h44. Dans cette expérience, le glissement de la capsule de la tête était habituellement terminé 6 à 12 heures après l'enlèvement des larves des goujons. De cette façon, il n'y avait aucun point où les ocelles du groupe aux yeux bandés auraient pu recevoir de l'information visuelle sur les goujons. Les larves témoins n'ont pas été peintes ni transférées dans des boîtes d'isolement. L'ablation partielle du bandeau n'a été observée que deux fois sur un total de 11 480 contrôles dans toutes les expériences ; ces individus ont été retirés de l'expérience.
Quantification de la réponse de la couleur : La quantification et l'analyse de la couleur ont été effectuées comme décrit dans la référence20. La réflectance des larves du stade larvaire final et des goujons peints a été mesurée à l'aide d'un spectrophotomètre Ocean Optics USB2000, avec une source lumineuse halogène au deutérium DH-2000 et mesurée par rapport à une norme de réflectance WS-1. Les larves ont été refroidies dans un réfrigérateur pendant 2 à 10 minutes avant la mesure pour réduire les mouvements. Au total, six mesures ont été effectuées : trois à partir de la surface latérale gauche et trois à partir de la surface latérale droite de chaque individu, toujours enregistrées à partir du troisième segment thoracique et des deuxième et sixième segments abdominal. Ceci afin d'éviter le chevauchement des mesures et parce que ces segments ne présentaient pas de marques proéminentes. Toutes les données de spectrométrie ont été enregistrées avec Overture v.1.0.1.
Nous avons traité les spectres à des intervalles de 1 nm dans le spectre de la lumière visible (300-700) à l'aide d'un programme MATLAB (fourni par I. C. Cuthill), et modélisé la vision dans l'espace couleur aviaire à l'aide de photons coniques pris dans la mésange bleue, Cyanistes caerulus22. Les valeurs de stimulation des cônes ont été converties en coordonnées cartésiennes et tracées dans un espace tétraédrique à l'aide d'un script MATLAB personnalisé45, de sorte que chaque cône est représenté par un axe. Cet espace colorimétrique est utile parce que si une couleur ne stimule qu'un seul type de cône, ses coordonnées se trouvent à l'extrémité appropriée du tétraèdre, et lorsque les quatre types de cônes sont également stimulés, ses coordonnées se trouvent à l'origine (figure 2 supplémentaire).
Pour fournir une mesure plus simple de la couleur, nous avons calculé la verdeur comme étant le rapport entre les valeurs de capture du cône des photorécepteurs de longueur d'onde moyenne et de longue longueur d'onde[MW/(MW + LW)], qui représentent les mécanismes opposés, en suivant Arenas et Stevens46. Pour l'expérience des goujons en noir et blanc, nous avons modélisé la réponse à la luminance mais pas à la couleur. Nous n'avons donc analysé que la prise du cône DD de titrage bleu, car ces cônes médient la vision de luminance22,47.
Nous avons modélisé la facilité avec laquelle un prédateur aviaire pourrait faire la distinction entre les goujons et les larves à l'aide du JND ; pour les mathématiques, voir Vorobyev et Osorio23. Pour les contrastes chromatiques, nous avons utilisé les sensibilités spectrales du titrage bleu à travers des rapports de cônes relatifs de SW = 0,7111 ; MW = 0,9926 ; LW = 1,0 ; et UV = 0,370448, avec une fraction Weber de 0,05 et une irradiance idéalisée (D65). Pour modéliser les JND de luminance, nous avons utilisé des cônes DD de titrage bleu. JND < 1,00 indiquent que deux stimuli sont indiscernables ; les stimuli différant de 1 à 3 unités JND ne sont discriminables que dans de bonnes conditions d'observation ; les stimuli présentant des valeurs supérieures devraient pouvoir être distingués avec une facilité croissante49.
Choix du microhabitat : Les larves qui avaient été élevées sur des chevrons bruns et verts ont été placées dans deux chambres de choix : l'une avec un choix de deux chevrons croisés en diagonale et l'autre avec un seul cheville horizontal. La raison d'être de l'utilisation de deux modèles était de tester les larves dans des conditions de départ différentes, ce qui peut produire des réponses d'échappement initiales non sélectives (sur tout rameau lorsque la larve est placée sur une surface plane). Toutes les expériences de microhabitat ont été menées sur 12 individus à la fois dans une chambre d'essai polyvalente Sanyo (modèle MLR-351) au niveau de lumière 4 (15 000 lx).
La chambre diagonale de choix de l'habitat se composait d'un cube de plastique transparent mesurant 70 × 70 × 80 mm (longueur × largeur × profondeur, y compris le couvercle) et contenant deux goujons diagonalement croisés de 100 mm de long peints dans les couleurs contrastantes (brun ou vert) sur lesquelles les larves étaient élevées lors des expériences avec bandeau (figure supplémentaire 16A). Des larves individuelles ont été placées à égale distance de chaque cheville sur la base des boîtiers diagonaux des goujons. Avant la mise en place, les larves ont été légèrement piquées à l'aide d'une pince à épiler trois fois le long de la surface dorsale pour simuler la prédation, car le risque de prédation augmente la probabilité de choix du microhabitat24. Un autocollant avec l'identification des larves a été apposé sur le côté de chaque chambre. Les individus ont été laissés pendant 12 h (7 h de lumière sombre et 5 h de lumière, choisies pour réduire la perturbation du rythme circadien naturel des larves), après quoi la couleur de la cheville sur laquelle reposait chaque chenille a été enregistrée, suivie de l'ID de larve. Un enregistrement a été effectué par larve.
désolé je n'ai pas tout traduit...

Après la quantité importante d'articles à charge sur les Ummo ainsi que son dénigrement en règle des "suiveurs", que change cette info ?
 Hector01Equipe du forum
Hector01Equipe du forum

 Age : 61
Age : 61
Nombre de messages : 1247
Inscription : 16/04/2010
Localisation : Paris
Emploi : privé
Passions : jardinage, cosmologie
Règlement : Règlement
Points de Participation : 7768
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Mar 22 Oct 2019, 08:30
Bonjour.
Merci pour cette traduction qui a un intérêt pour une meilleure connaissance du vivant.
Cependant, que les prétendus Ummites puissent percevoir les couleurs avec leurs doigts, pourrait être intéressant pour un roman de SF, et je n'ose imaginer par quel moyen incongru ils pourraient se reproduire.
Sans doute la liste des articles scientifiques mobilisables pour démontrer la pertinence de situations décrites par les auteurs de la science-fiction pourrait être longue.
Merci pour cette traduction qui a un intérêt pour une meilleure connaissance du vivant.
Cependant, que les prétendus Ummites puissent percevoir les couleurs avec leurs doigts, pourrait être intéressant pour un roman de SF, et je n'ose imaginer par quel moyen incongru ils pourraient se reproduire.
Sans doute la liste des articles scientifiques mobilisables pour démontrer la pertinence de situations décrites par les auteurs de la science-fiction pourrait être longue.
 snotgobblerEquipe du forum
snotgobblerEquipe du forum

 Age : 65
Age : 65
Nombre de messages : 232
Inscription : 04/07/2019
Localisation : Grand est
Emploi : sans
Passions : la vie
Règlement : Règlement
Points de Participation : 2381
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Mar 22 Oct 2019, 09:55
Bonjour Hector one 
La science vient prouver un sens de perception nouveau. C'est donc une capacité du vivant qui corrobore l'affirmation Oummaine. [size=16]L'article de Nature est daté d'Octobre 2019. La lettre D99 a été écrite au début des années soixante dix. Soit 48 ans après.
[/size]
Vous avez remarqué ? Que des faits !
Pour la reproduction Oummaine, comme je l'indique, la lettre D99 répond à vos questions.
Naturellement j'ai bien saisi la nature de votre réponse.

La science vient prouver un sens de perception nouveau. C'est donc une capacité du vivant qui corrobore l'affirmation Oummaine. [size=16]L'article de Nature est daté d'Octobre 2019. La lettre D99 a été écrite au début des années soixante dix. Soit 48 ans après.

[/size]
Vous avez remarqué ? Que des faits !
Pour la reproduction Oummaine, comme je l'indique, la lettre D99 répond à vos questions.
Naturellement j'ai bien saisi la nature de votre réponse.

 InvitéInvité
InvitéInvité
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Jeu 24 Oct 2019, 20:01
snotgobbler a écrit:
La science vient prouver un sens de perception nouveau. C'est donc une capacité du vivant qui corrobore l'affirmation Oummaine. [size=16]L'article de Nature est daté d'Octobre 2019. La lettre D99 a été écrite au début des années soixante dix. Soit 48 ans après.
[/size]
Vous avez remarqué ? Que des faits !
Bonjour Snotglobber
Ravie de vous voir aussi heureux de cette découverte.
Comme le dit pertinemment Hector01, si on devait faire la liste de tous les auteurs de SF, de romans d'anticipation et des autres tel que Jules Verne et Léonard de Vinci, qui ont pressenti les évolutions technologiques et scientifiques, cette liste serait longue... très longue.
Pour ce qui est des ummites... heuh Oummites... enfin vous voyez de qui je parle, ce qui serait intéressant, mais vraiment très très intéressant, spectaculaire d'ailleurs, ce serait si ces derniers avaient expliqué en détail dans la lettre D99, comment ils arrivaient à une telle faculté, explications détaillées étout, étout , comme que le fait la revue Nature pour le cas présenté.
Et là, on aurait ce que vous appelez des faits. Si c'est le cas.... comment dire, on pourrait être "interpellé" par tous ces courriers.
Tout comme nous pourrions être interpellé par un cercle de culture qui nous indiquerait une formule mathématique ou physique inconnue qui nous révélerait quelque chose d'extraordinaire. Ce qui n'est pas le cas pour l'heure.
Est-ce que la lettre D99 nous donne des explications détaillées?
Cordialement
Nanou
 snotgobblerEquipe du forum
snotgobblerEquipe du forum

 Age : 65
Age : 65
Nombre de messages : 232
Inscription : 04/07/2019
Localisation : Grand est
Emploi : sans
Passions : la vie
Règlement : Règlement
Points de Participation : 2381
 Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Re: L'affaire UMMO: Alerte aux "envahisseurs" ummites la fin du cirque!
Jeu 24 Oct 2019, 20:46
Bonsoir Nanou Ti
Merci de votre message "équilibré".
Il ne vous a pas échappé que la perception des couleurs par la peau est une perception complétement nouvelle et ce n'est pas de la science fiction mais un fait biologique que personne (scientifique) n'aurait pu envisager.
Maintenant pourquoi voulez vous que les ummites détaillent un séquencement des gènes dans une lettre de 1971 alors que les humains ne maitrisent le sujet que depuis les années 1990 ?
Maintenant quand un humain dit qu'il possède un sens du toucher, vous ne demandez pas la preuve génétique de son affirmation, non? à moins d'être partisan de la zététique?
Connait-on la séquence de gène du toucher chez l'homme?
Je ne suis pas généticien mais peut-être l'êtes vous ? Merci de nous éclairer sur le sujet.
En relisant votre message, je ne trouve pas de fait autre que les hommes ont de l'imagination et qu'un auteur de science fiction (lequel?) aurait pu l'inventer. Permettez moi de trouver ça un peu juste comme argumentation.
Il est hélas courant que les cercles ufologiques mettent en avant l'aveu d'un psychologue Jose luis Jordan Pena et ces critiques sont souvent à charge. Pour moi, cela manque pour le moins d'équilibre car connaissez vous un autre dossier avec autant de faits scientifiques? Pourquoi pensez vous qu'un simple changement de variable dans l'équation de schwarzchild, perturbe autant Jean Pierre Petit ? Comprenez vous qu'un esprit scientifique puisse être troublé ?
Maintenant convaincre ? Vous avez des personnes qui nient l'alunissage d'appollo 11 alors je veux juste partager l'information, sans plus. Tout autre but serait illusoire.
Merci de votre message "équilibré".
Il ne vous a pas échappé que la perception des couleurs par la peau est une perception complétement nouvelle et ce n'est pas de la science fiction mais un fait biologique que personne (scientifique) n'aurait pu envisager.
Maintenant pourquoi voulez vous que les ummites détaillent un séquencement des gènes dans une lettre de 1971 alors que les humains ne maitrisent le sujet que depuis les années 1990 ?
Maintenant quand un humain dit qu'il possède un sens du toucher, vous ne demandez pas la preuve génétique de son affirmation, non? à moins d'être partisan de la zététique?
Connait-on la séquence de gène du toucher chez l'homme?
Je ne suis pas généticien mais peut-être l'êtes vous ? Merci de nous éclairer sur le sujet.
En relisant votre message, je ne trouve pas de fait autre que les hommes ont de l'imagination et qu'un auteur de science fiction (lequel?) aurait pu l'inventer. Permettez moi de trouver ça un peu juste comme argumentation.
Il est hélas courant que les cercles ufologiques mettent en avant l'aveu d'un psychologue Jose luis Jordan Pena et ces critiques sont souvent à charge. Pour moi, cela manque pour le moins d'équilibre car connaissez vous un autre dossier avec autant de faits scientifiques? Pourquoi pensez vous qu'un simple changement de variable dans l'équation de schwarzchild, perturbe autant Jean Pierre Petit ? Comprenez vous qu'un esprit scientifique puisse être troublé ?
Maintenant convaincre ? Vous avez des personnes qui nient l'alunissage d'appollo 11 alors je veux juste partager l'information, sans plus. Tout autre but serait illusoire.
Permission de ce forum:
Vous ne pouvez pas répondre aux sujets dans ce forum
 Témoigner
Témoigner